记者|张乔遇
近日,泽辉生物科技有限公司(简称:泽辉生物)赴港递交招股书,中金公司为保荐机构。
泽辉生物是一家2017年12月在苏州设立的生物制药公司,专注于开发多能干细胞(PSC)来源的创新细胞治疗产品。其开发的全面及差异化产品管线涵盖了七种适应症,其中核心产品ZH901已进入II期临床阶段。然而,截至目前,泽辉生物尚无获批上市进行商业化销售的产品,因此尚未产生自产品销售收入。
此外,泽辉生物在IPO前与部分投资者签订了股东协议,其中授予了前投资者一些特别权利,包括在特定情况下(如公司未能在规定时间内完成IPO)要求赎回的赎回权。
IPO前,泽辉生物实际控制人金韵持有公司44.98%的股份,通过两家控股公司Xiangjing PhaseII和Zephyrm Tongchuang PhaseII分别持股38.33%和6.65%。据悉,金韵为公司首席执行官Yu Alex ZHANG博士的母亲。
尚未实现商业化销售
根据弗若斯特沙利文的资料,泽辉生物是中国首批获得PSC来源细胞疗法新药临床试验申请(IND)批准的公司。
公司开发了由四类PSC来源细胞治疗产品组成的全面及差异化产品管线,涵盖七种适应症,包括间质性肺疾病急性加重(“AE-ILD”)、急性移植物抗宿主病(“aGVHD”)、半月板损伤、急性呼吸窘迫综合征(“ARDS”)、帕金森病、干性年龄相关性黄斑变性(“AMD”)及角膜内皮失代偿。
目前泽辉生物的产品组合包括核心产品ZH901以及主要产品ZH903、ZH902、ZH906。截至2024年9月20日,泽辉生物的核心产品ZH901已进入II期临床阶段,该产品是一种M细胞治疗产品,目前正在研究用于治疗AE-ILD、aGVHD、半月板损伤和ARDS。
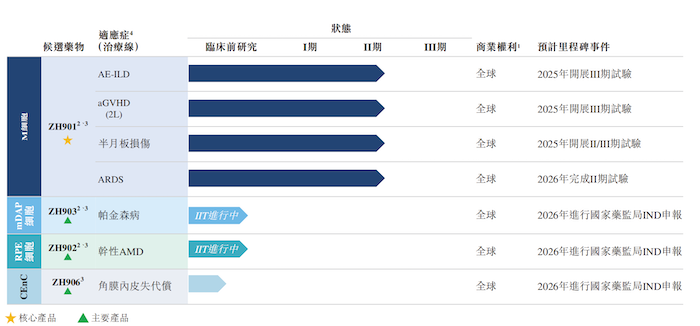
除此之外,泽辉生物的主要在研项目ZH903和ZH902目前正在进行研究者发起的试验(“IIT”),分别用于治疗帕金森病和乾性AMD。另一产品ZH906用治疗角膜内皮失代偿,正处于临床前阶段。
可以看到,目前泽辉生物尚无获批上市进行商业化销售的产品,因此没有自产品销售产生的任何收入。
目前来看,泽辉生物进展最快的管线也仅处于II期临床试验阶段,相关项目临床前及临床试验开支、研发材料开支、员工福利开支、适应症研究和相关费用等研发支出金额庞大,报告期(2022年、2023年及2024年上半年)分别为6631.1万元、1.03亿元和5851.5万元,导致报告期持续亏损。
招股书显示,泽辉生物报告期的净利润分别为-1.73亿元、-1.96亿元、-2.37亿元,累计亏超6亿元,且亏损金额持续扩大。
报告期各期,泽辉生物的净流动负债为4.55亿元、6.40亿元、8.00亿元;负债净额分别为3.69亿元、5.65亿元和6.56亿元。公司预计将在2024年末继续产生经营亏损。
值得一提的是,PSC来源细胞疗法产品有两个潜在安全问题。一个潜在问题系与残留的PSC有关,该干细胞在移植到患者体内后可能会生长成肿瘤。另一个潜在安全问题系与移植细胞发生免疫排斥的可能性有关。
高价引进专利技术
泽辉生物开发了一个多功能干细胞来源的细胞治疗研发平台(PROF),该平台包含多能干细胞种子细胞平台(“PROF-seed”)、关键功能细胞筛选研发平台(“PROF-function”)及处方优化平台(“PROF-formulator”)三个独立体系的技术平台。
界面新闻记者注意到,除了自主开发外,泽辉生物还和第三方合作来支持在研产品开发。其中包括公司内部产品开发活动中使用的若干许可引进的技术。
2019年至2024年9月,泽辉生物已经和中国科学院动物研究所和北京干细胞与再生医学研究院订立战略合作协议及补充协议。
根据合作协议,对方为泽辉生物提供两条临床级人胚干细胞(hESC)系的排他性专利,以及M细胞、中脑多巴胺前体(mDAP)细胞及视网膜色素上皮(RPE)细胞的相关专利权在全球范围的排他性专利,以研究、开发、生产要约销售及商业化源自干细胞的针对所有潜在适应症的治疗产品。根据该协议,泽辉生物必须向合作伙伴支付包括首期付款、里程碑付款及特许权使用费付款等。

具体来看,2019年泽辉生物完成了购买M cells许可引进的专有技术,对价为1.00亿元,2023年,公司完成了购买mDAP细胞及RPE细胞许可引进专有技术,每项许可引进的专有技术对价为1.00亿元,共计3亿元。
购买特定专有技术许可涉及长期付款安排(含融资),技术成本最初按协议中固定费用(主要是首付款)的折现值确认,里程碑付款作为无形资产的可变付款在产生时计入成本,而特许权使用费则根据治疗产品的销售额累计并确认为销售成本的一部分。
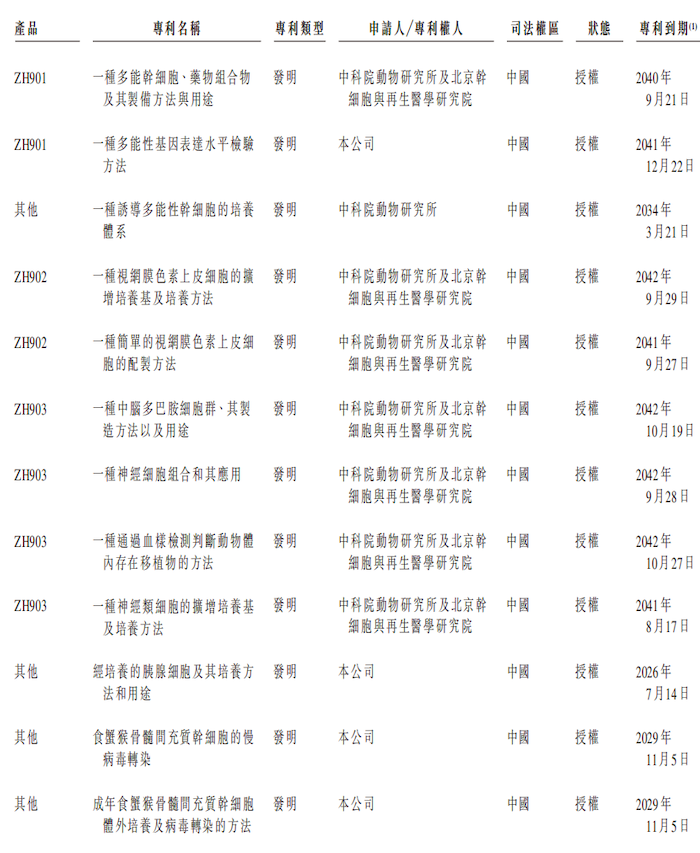
截至2024年9月27日,泽辉生物拥有对公司业务重大的专利共计32项,其中20项专利仍未获授权,剩余已获授权的专利中,只有4项专利的专利权人为泽辉生物,其余项目的专利权人为中科院动物研究所及北京干细胞与再生医学研究院。并且剩下的四项专利中,关于核心产品ZH901的相关专利只有1项。
研究面临伦理挑战
需要指出的是,hESC为一种存在于人囊胚的内细胞团中的PSC,囊胚是受精后第4至第7天发育胚胎的早期阶段。在正常的胚胎发育过程中,其于第7天后消失,并开始形成三个胚胎组织层。
值得注意的是,用于新hESC系来源的胚胎是在父母双方知情同意的情况下通过体外受精诊所获得。只有无法用于不孕治疗的多余胚胎才能用于获取hESC。然而,这种获取通常需要破坏子宫外胚胎,此举会引起伦理问题,在许多国家均为法律所禁止。
在中国,科学技术部及原卫生部于2003年发布的《人胚胎干细胞研究伦理指导原则》(“《指导原则》”)规定,通过体外受精、体细胞核移植、孤雌生殖或基因改造获得的囊胚的培养期不应超过受精或核移植后的14天,但禁止对超过14天(或原条最早出现时)的胚胎进行的研究。
在美国,含有细胞的治疗产品(包括PSC来源产品)被视为生物制品或医疗器械,并受到一系列政策的支持。虽然联邦政府致力于促进干细胞疗法产品的发展,但州一级的法律仍然存在分歧,一些州表示支持,而一些州则实施禁令。
在欧盟,基于细胞的治疗产品(包括PSC来源产品)被视为需要监管批准的ATMP。这些产品必须遵守关于供体及细胞制备、储存及转移等流程的指令,并遵循ATMP的GMP指南。然而,欧盟尚未就成员国的干细胞研究发布一致的法规。
截至2024年9月21日,全球已有14种治疗性干细胞来源产品获得监管机构的批准上市,包括EMA、PMDA及MFDS。该产品均来自ASC,世界上尚且没有获准上市的PSC来源细胞疗法产品,也没有获准在中国上市的干细胞来源细胞疗法产品。中国有8种PSC来源细胞治疗产品处于临床开发。其中,泽辉生物的ZH901是中国首个亦为唯一一个源自hESC的干细胞来源细胞治疗在研产品。






还没有评论,来说两句吧...